部門紹介

医局
看護局
事務局
外来
救急病棟
一般病棟
専門病棟
コメディカル部門
患者サポートセンター
患者相談
入院時から地域生活を見据え、患者さんやご家族が安心して治療を受けられるようタイムリーに専門職の相談を受けられるようにします。
入退院支援
病院の受入調整窓口を一元化することにより、受診相談から、入院、退院、地域での定着までを総合的に支援します。
入院中からその人らしさを大切にし、本人のペースでアウトリーチ(訪問)を行っていきます。特に、長期入院患者さんの退院促進に向けて訪問看護の充実を図ります。
患者さんの病状や病棟役割等に応じて適切なベッドコントロールを行います。
地域連携
関係機関向けの「病院見学会」「医療機関訪問」等、市民、医療・介護・福祉職、行政関係者が学べる場を設けていきます。
地域に出向き、顔の見える関係づくりを行いながら、地域の困りごとを一緒に検討していきます。
単科精神科病院、クリニック等で対応の難しいケースの受入を行います。
医療安全推進
臨床研究
- 専門治療(specialized-treatment/index.html)
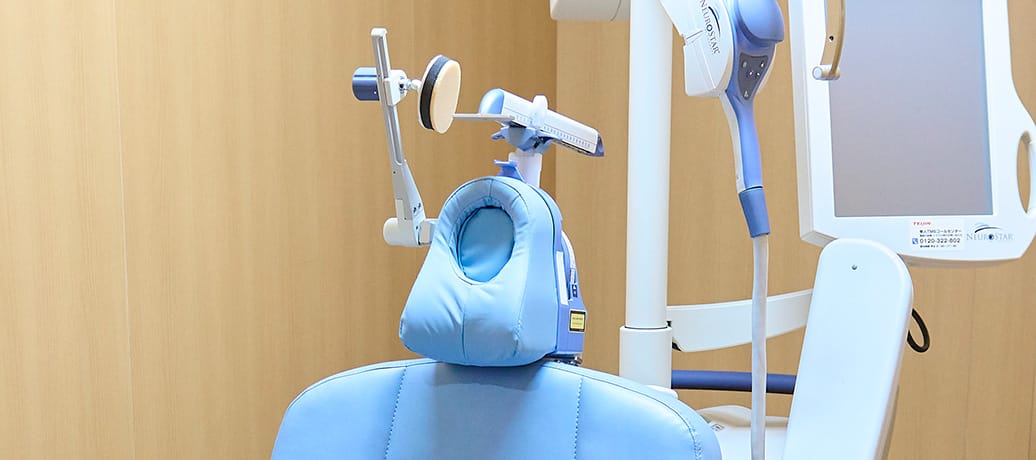
神奈川精神医療センターの専⾨治療
- 外来のご案内(outpatient/index.html)

外来のご案内

